상대적으로 부작용 우려 적은 합성항원 백신
국내에서는 SK바이오사이언스가 CDMO
[아시아경제 이춘희 기자] 노바백스의 코로나19 백신이 미국 식품의약국(FDA) 긴급사용승인을 받았다.
FDA는 13일(현지시간) 노바백스 백신의 관련 자료를 검토한 결과 18세 이상을 대상으로 잠재적 위험보다 이익이 더 크다고 판단된다며 18세 이상 긴급사용을 승인한다고 밝혔다. 미국 내에서는 화이자, 모더나, 얀센(존슨앤드존슨 자회사)에 이어 네 번째로 승인된 코로나19 백신이다. 네 번째 코로나19 백신이 사용되게 됐다.
로버트 캘리프 FDA 국장은 "추가 코로나19 백신 허가는 코로나19 예방을 위한 백신 선택지를 확대하는 것"이라며 "아직 코로나19 백신 접종을 받지 않은 미국 성인들에게 또 다른 선택지를 제공할 것"이라고 전했다. 그는 이어 "백신은 여전히 심각한 질병을 막을 최선의 조치"라며 "아직 코로나19 백신을 맞지 않은 이들이 접종을 고려하도록 독려한다"고도 말했다.
앞서 식품의약품안전처는 지난 1월 노바백스 백신의 임상시험 최종결과보고서 등을 제출하는 조건으로 품목허가를 결정한 바 있다. 지난 12일까지 총 59만870건의 국내 접종이 이뤄졌다. 특히 이 중 절반 가까운 29만1763건은 4차 접종으로 이뤄졌다.
이는 기존에 다른 백신을 맞았더라도 희망할 경우 3·4차 접종을 노바백스 백신으로 접종할 수 있도록 한 데 따른 것이다. 독감, B형 간염, 자궁경부암 등 각종 백신에 전통적으로 쓰여온 방식인 합성항원 백신으로 개발돼 부작용에 대한 우려가 상대적으로 낮아 선호도가 올라간 것으로 분석된다.
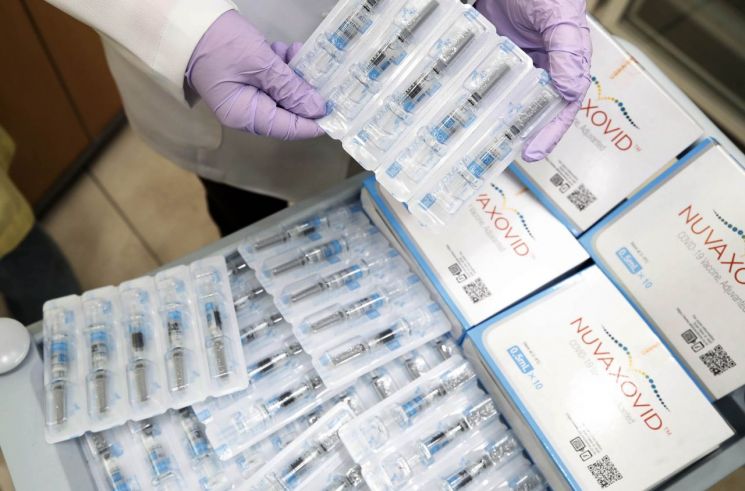
현재 국내에서는 SK바이오사이언스가 노바백스 백신을 위탁개발생산(CDMO)하고 있다. 특히 노바백스 백신은 해외에서는 대부분 10회분이 함께 담긴 바이알 형태로 유통되지만 SK바이오사이언스는 추가 연구 개발을 통해 1개당 1회 용량이 담긴 '프리필드시린지' 형태로의 추가 개발을 진행했다. 별도의 희석 또는 소분 절차 과정에서 생길 수 있는 오염 우려가 낮고 접종 편의성도 높다.
지금 뜨는 뉴스
다만 미국 내 유통되는 노바백스 백신은 우선적으로는 세계 최대 백신 제조사인 인도혈청연구소(SII) 생산 물량이 공급될 가능성이 높다. 이번 FDA 긴급사용승인은 SII에 대한 실사 등을 토대로 이뤄졌기 때문이다.
이춘희 기자 spring@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>

![전문가 4인이 말하는 '의료 생태계의 대전환'[비대면진료의 미래⑥]](https://cwcontent.asiae.co.kr/asiaresize/319/2026013014211022823_1769750471.png)














![또 19억 판 아버지, 또 16억 사들인 아들…농심家 '셋째 父子'의 엇갈린 투심[상속자들]](https://cwcontent.asiae.co.kr/asiaresize/308/2026013009165322085_1769732214.jpg)

![쿠팡 잡으려고 대형마트 새벽배송…13년 만의 '변심'에 활짝 웃는 이곳[주末머니]](https://cwcontent.asiae.co.kr/asiaresize/308/2025042307522530624_1745362344.jpg)





