[아시아경제 권재희 기자] 미국 식품의약국(FDA)가 머크앤드컴퍼니(이하 머크)가 개발한 코로나19 경구용 치료제의 긴급 사용 승인을 위한 심사에 착수한다. 하지만 외부 자문단 심사를 거치기로 해 12월 이전 승인은 어려울 것으로 전망된다.
15일(현지시간) 블룸버그통신에 따르면 FDA는 머크의 경구용 코로나19 치료제 '몰누피라비르'의 긴급 사용 승인 여부를 외부 자문단 심사를 거쳐 결정하기로 하고 오는 11월 30일 외부 자문단 회의를 열기로 했다.
외부 자문단은 이 자리에서 몰누피라비르의 안전성과 유효성 등을 따져볼 예정이다.
FDA는 상황의 긴급성 등을 고려해 때에 따라 외부 자문단 검토 단계를 생략하기도 한다.
그러나 MSD의 긴급 사용 승인 신청을 두고 일부 전문가들이 안전에 대한 우려를 제기한 까닭에 최종 결정을 내리기 전 자문단 의견을 수렴하기로 했다.
또 MSD가 제출한 몰누피라비르 임상 데이터에 관한 의견도 전달할 예정이다.
외부 자문단의 첫 회의가 11월 30일로 정해지고 자문단의 의견을 검토해 FDA가 최종 결정을 하는 절차를 고려할 때 코로나19 첫 경구치료제의 사용 승인은 12월 이전에 나오기는 어려울 것으로 보인다.
FDA는 "몰누피라비르의 긴급 사용 여부를 결정하는 데 있어 외부자문단 검토는 과학적 데이터와 정보를 명확히 이해하는 데 도움을 줄 것"이라고 밝혔다.
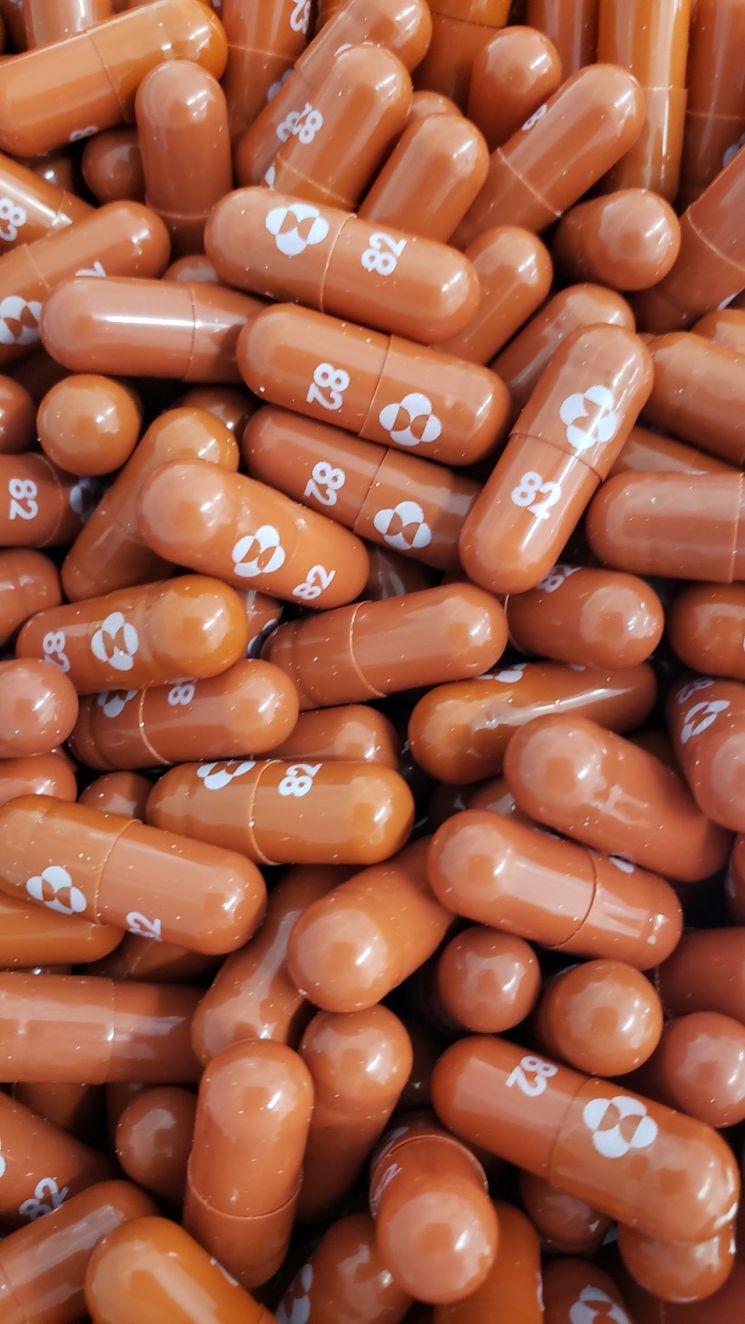
몰누피라비르는 경미하거나 보통 수준의 증세를 보이지만 중증으로 진행할 위험이 높은 성인 코로나19 환자를 위해 개발된 치료제다.
지금 뜨는 뉴스
MSD는 올해 말까지 1000만 명분을 생산할 예정이다. 미 연방정부는 170만 명분에 대한 사전구매 계약을 맺은 것으로 알려졌다. .
권재희 기자 jayful@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>






![전문가 4인이 말하는 '의료 생태계의 대전환'[비대면진료의 미래⑥]](https://cwcontent.asiae.co.kr/asiaresize/319/2026013014211022823_1769750471.png)














!['나의 최애' 연예인도 아닌데 얼굴 보러 '북적'…다카이치 팬덤활동 '사나카츠' [日요일日문화]](https://cwcontent.asiae.co.kr/asiaresize/308/2026021115583038893_1770793111.png)


![北 김정은 얼굴 '덥석'…'예뻐해 함께 다닌다'는 김주애가 후계자? 아들은?[양낙규의 Defence Club]](https://cwcontent.asiae.co.kr/asiaresize/308/2023042407464898154_1682290007.jpg)
![잘못 봤나? 가격표 다시 '확인'…등장할 때마다 화제되는 이부진 '올드머니룩'[럭셔리월드]](https://cwcontent.asiae.co.kr/asiaresize/308/2026010919492186081_1767955761.jpg)