화이자 이어 두 번째
고령자·고위험군 대상
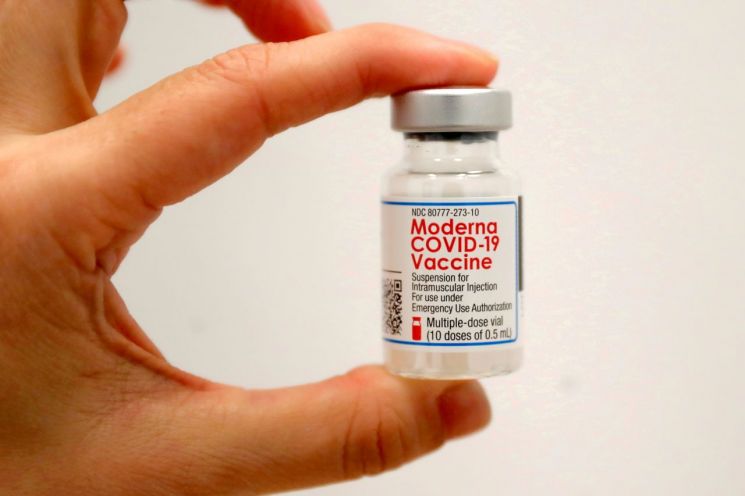
[아시아경제 조현의 기자] 미국 식품의약국(FDA) 자문기구가 14일(현지시간) 모더나의 코로나19 백신 부스터샷을 만장일치로 권고했다. 지난달 화이자에 이어 두 번째다.
AP통신 등에 따르면 FDA 자문기구인 백신·생물의약품자문위원회(VRBPAC)는 이날 회의에서 만장일치 표결로 이같이 결정했다.
접종 대상은 모더나 백신 2회 차를 맞은 지 최소 6개월이 지난 65세 이상 고령자, 기저질환자와 면역 취약자, 의료진 등 고위험군이다. 투여량은 1·2차 정규 투여량의 절반이다.
이는 FDA가 지난달 승인한 화이자 부스터샷 접종 대상과 같다. 화이자와 모더나는 일반 성인을 대상으로 승인을 신청했지만 보건당국은 그 대상을 크게 줄였다.
FDA 자문위의 결정은 권고 성격으로, 구속력은 없지만 FDA는 이를 대체로 받아들이는 편이다. 다만 FDA의 승인이 이뤄져도 미국 내 사용을 위해선 질병통제예방센터(CDC)의 논의 절차를 거쳐야 한다.
모더나는 이날 회의에서 부스터샷이 돌파감염이나 경미 또는 중간 수준의 증상을 겪는 질환을 막는 데 효과가 있다고 강조했다. 하지만 다수의 자문위원들은 관련 임상실험 데이터가 충분하지 않다고 봤다.
자문위가 이 같은 우려에도 승인을 권고한 것은 화이자 부스터샷이 이미 승인된 것을 종합적으로 고려한 데 따른 것이다. 일부 위원들은 "FDA가 비상상황을 이유로 화이자 부스터샷을 승인해 좋지 않은 선례를 남겼다"고 지적하기도 했다.
FDA는 이날 화이자와 모더나의 부스터샷 접종 대상을 일반 성인으로 확대할지도 논의할 계획이었지만 일부 위원들이 거부하면서 무산됐다.
지금 뜨는 뉴스
자문위원인 폴 아핏 필라델피아아동병원 백신교육센터 소장은 "부스터샷 접종을 일반 성인까지 확대하는 것에 전혀 동의하지 않는다"며 "(일반 성인도) 3차 접종을 하지 않으면 코로나19로부터 보호가 안 된다는 잘못된 메시지를 전달할 수 있다"고 비판했다.
조현의 기자 honey@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>







![전문가 4인이 말하는 '의료 생태계의 대전환'[비대면진료의 미래⑥]](https://cwcontent.asiae.co.kr/asiaresize/319/2026013014211022823_1769750471.png)














![데려올 때 38만원, 떠나보낼 때 46만…가슴으로 낳아 지갑으로 키우는 반려동물[펫&라이프]](https://cwcontent.asiae.co.kr/asiaresize/308/2026020509403529611_1770252035.jpg)



