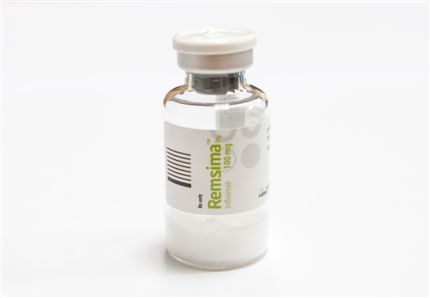
[아시아경제 신범수 기자]셀트리온의 바이오시밀러 '램시마'가 식약청 허가를 획득했다. 전 세계 제약업체들의 신성장동력으로 각광 받아온 바이오시밀러 시장이 본격적으로 열렸음을 알리는 신호탄이다.
식품의약품안전청은 류마티스관절염 치료제 램시마의 판매허가를 승인한다고 23일 밝혔다. 램시마는 존슨앤존슨이 개발하고 한국얀센이 국내 판매 중인 '레미케이드'를 복제한 바이오시밀러다.
레미케이드나 유방암치료제 허셉틴 등 바이오의약품은 같은 질병을 치료하는 화학합성의약품에 비해 부작용이 적고 효과가 좋다는 장점이 있다. 그러나 기술장벽이 높으며 품질 균등성 확보가 어려워 세계 굴지의 다국적제약사 몇 곳이 독점하는 시장이다. 약값도 화학의약품에 비해 훨씬 비싸다.
바이오시밀러의 등장은 이런 독점구조가 깨짐으로써 환자 부담이 크게 감소한다는 측면에서 중요한 의미가 있다. 레미케이드의 경우 1병 가격이 55만원에 달하며, 환자 1인당 매년 약값으로만 수백만원이 소요된다.
램시마의 판매가격은 정부와의 가격협상을 거쳐 정해진다. 업계에서는 복제약의 특성상 신약값의 80% 수준이 될 것으로 전망하고 있다. 서정진 셀트리온 회장은 지난 6월 유럽류마티즘학회(EULAR)에서 램시마 임상시험 결과를 발표하며 "국내 환자를 위해 '리펀드 제도'를 실시하는 방안을 고려하고 있다"고 말했다.
환자가 비용을 지불하고 차후에 일정 금액을 회사가 돌려주는 방식으로 치료비를 지원하겠다는 의미다. 서 회장은 "화학의약품에 비해 효과가 좋음에도 가격 때문에 항체의약품을 사용하지 못하던 환자들에게 치료기회를 주고 싶다"고 말했다.
이번 판매허가는 셀트리온과 같은 후발 바이오업체들의 기술력이 다국적제약사 수준에 근접했음을 입증했다는 의미도 있다. 바이오신약을 보유한 다국적제약사들은 "생산기술의 난이도 때문에 신약과 동등한 복제약을 만드는 것은 쉽지 않을 것"이라며 후발업체들을 평가절하 해왔다. 이에 7개 국내 제약사가 개발 중인 8개 항체의약품에 대한 개발 및 허가에도 속도가 붙을 전망이다.
식약청 관계자는 "성장호르몬 등 1세대 바이오의약품에 비해 항체의약품은 분자량이 크고 구조가 복잡해 개발 및 평가가 어렵다"며 "2세대 바이오의약품의 공식 허가는 이런 측면에서 의미가 크다"고 말했다.
#용어설명 : 항체의약품과 바이오시밀러
바이오의약품은 생물공학기술을 활용한 의약품을 총칭하는 말이다. 세포치료제, 유전자치료제, 백신 등이 포함된다. 셀트리온이 개발한 램시마는 이 중 단일클론항체(Monoclonal antibody, Mab) 의약품에 속한다. 바이오의약품 시장에서 백신을 제외하고 가장 시장규모가 큰 분야다. 환자의 면역시스템을 자극해 세포를 공격하게 하는 방식으로 질병을 치료한다. 램시마는 항체의약품을 복제한 세계 최초의 바이오시밀러다. 바이오의약품은 살아있는 생물 세포를 활용하기 때문에 기존 제품과 100% 동일하게 만들 수 없다. 구조적으로 완벽히 같다는 의미에서 '카피(copy)', '제네릭(generic)'이란 용어를 쓰는 화학의약품과 달리 "유사하다"는 의미의 시밀러(similar)란 용어를 사용한다.
신범수 기자 answer@
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>






![전문가 4인이 말하는 '의료 생태계의 대전환'[비대면진료의 미래⑥]](https://cwcontent.asiae.co.kr/asiaresize/319/2026013014211022823_1769750471.png)












![北 김정은 얼굴 '덥석'…'예뻐해 함께 다닌다'는 김주애가 후계자? 아들은?[양낙규의 Defence Club]](https://cwcontent.asiae.co.kr/asiaresize/308/2023042407464898154_1682290007.jpg)
![수능 마친 고3들 '필수 코스'였는데…요즘 청년들, 면허 취득 미룬다는데[세계는Z금]](https://cwcontent.asiae.co.kr/asiaresize/308/2026021510301943056_1771119019.jpg)
![잘못 봤나? 가격표 다시 '확인'…등장할 때마다 화제되는 이부진 '올드머니룩'[럭셔리월드]](https://cwcontent.asiae.co.kr/asiaresize/308/2026010919492186081_1767955761.jpg)



