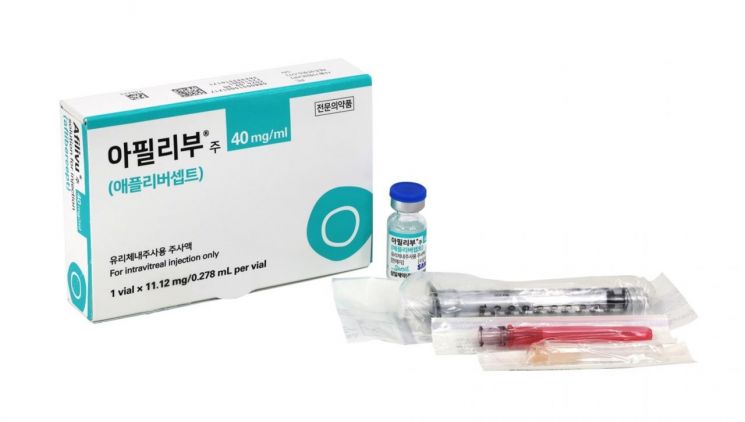
삼성바이오에피스가 안과질환 약 아일리아의 바이오시밀러로 개발한 오퓨비즈가 해당 제품의 바이오시밀러 중 최초로 미국에서 허가받았다.
20일(현지시간) 미국 식품의약국(FDA)는 오퓨비즈와 인도 바이오콘바이오로직스가 개발한 예사필리를 승인했다고 밝혔다. 지난해 총 17조원의 매출을 올린 글로벌 블록버스터 의약품인 아일리아의 바이오시밀러가 미국에서 승인된 건 이번이 처음이다. 오퓨비즈는 국내에서 아필리부로 허가돼 판매가 시작됐고, 예사필리도 지난해 유럽과 영국에서 승인받은 바 있다.
오퓨비즈는 미국 리제네론과 독일 바이엘이 함께 개발한 황반변성 등의 안질환 치료제 아일리아의 바이오시밀러다. 황반변성은 대표적 실명 질환으로 꼽힌다. 망막의 핵심인 황반에 비정상적으로 자란 모세혈관에서 흘러나온 혈액 등이 망막에 들러붙어 시야를 가리게 된다. 노화가 대표적인 원인이다 보니 세계적인 고령화 추세 속에서 발병도 크게 늘고 있는 질환이다. 글로벌 시장조사기관 글로벌데이터는 미국, 프랑스, 독일 등 세계 주요 7개국(G7)의 황반변성 치료제 시장이 2021년 74억달러에서 2031년 275억달러(약 37조4550억원)까지 성장할 것으로 전망하고 있다.
황반변성은 새로운 혈관 생성을 막는 아일리아나 비슷한 기전의 항체치료제인 루센티스 등의 주사제를 직접 눈에 주기적으로 맞아 질병의 진행을 억제하는 치료가 이뤄진다. 아일리아는 지난해 93억6000만달러(약 13조원)의 매출을 기록했고, 루센티스도 바이오시밀러 출시의 영향으로 매출이 급감하고 있지만 여전히 14억7500만달러(약 2조원)의 연 매출을 기록하고 있다. 삼성바이오에피스는 이번 오퓨비즈 승인으로 2021년 승인받아 판매 중인 루센티스 바이오시밀러인 바이우비즈 등을 포함해 총 6종의 FDA 승인 바이오시밀러를 보유하게 됐다.
다만 오퓨비즈의 미국 출시 일정은 아직 미지수다. 오리지널 개발사인 리제네론이 삼성바이오에피스와 바이오콘을 비롯해 셀트리온, 암젠, 포마이콘 등 바이오시밀러 개발사들과 일제히 소송전에 나섰기 때문이다. 리제네론은 이들이 바이오시밀러 개발 과정에서 자사의 특허를 침해했다는 주장이다. 반대로 삼성바이오에피스와 셀트리온 등도 리제네론이 보유한 특허에 대한 무효 소송을 제기하는 등 치열한 공방전이 이어지고 있다. 셀트리온도 CT-P42의 임상 개발을 모두 마치고 미국, 한국, 캐나다, 유럽 등 글로벌 주요국에 허가를 신청한 상태다.
지금 뜨는 뉴스
리제네론은 이에 더해 투약 편의성 제고를 통한 격차 벌리기에 나서고 있다. 핵심 성분의 용량을 4배 높인 아일리아HD를 내놨다. 아일리아는 직접 환자의 눈에 주사를 넣어야 해서 환자의 치료에 대한 두려움이 큰 약이다. 이에 투약 주기를 기존 8주에서 16주로 늘려 환자의 부담은 절반으로 줄이면서도 효과는 유지했다. 지난해 8월 FDA 승인을 받은 지 불과 4개월여 만에 미국에서 1억6600만달러(약 2259억원)의 판매고를 올렸다.
이춘희 기자 spring@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>



![전문가 4인이 말하는 '의료 생태계의 대전환'[비대면진료의 미래⑥]](https://cwcontent.asiae.co.kr/asiaresize/319/2026013014211022823_1769750471.png)














![오입금 된 비트코인 팔아 빚 갚고 유흥비 쓴 이용자…2021년 대법원 판단은[리걸 이슈체크]](https://cwcontent.asiae.co.kr/asiaresize/308/2026020910431234020_1770601391.png)







