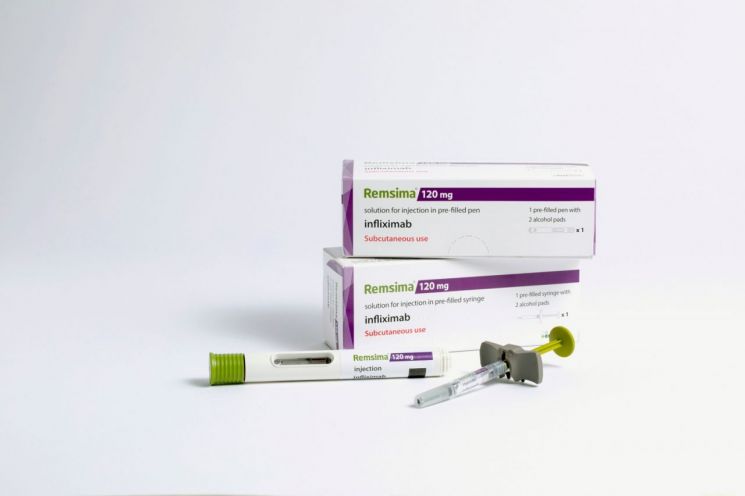
셀트리온은 캐나다 보건부로부터 자가면역질환 치료제 램시마SC(성분명 인플릭시맙)의 염증성 장 질환 적응증을 추가 승인받았다고 19일 밝혔다.
인플릭시맙 성분은 염증성 장 질환을 포함해 류머티즘 관절염, 강직성 척추, 건선 등 다양한 자가면역질환 치료에 쓰인다. 램시마SC는 캐나다에서는 2021년 류머티즘 관절염에 한해 적응증을 승인받았다가 이번 추가 승인으로 염증성 장 질환까지 영역을 넓히게 됐다. 크론병, 궤양성 대장염 등의 염증성 장 질환은 면역 체계가 대장 또는 소장을 공격해 다발성 궤양과 출혈, 설사, 복통을 일으키는 만성 난치성 장 질환이다. 글로벌 시장조사업체 더비즈니스리서치컴퍼니는 염증성 장 질환 세계 시장 규모가 올해 255억6000만달러(약 34조원)에 이를 것으로 추산한다.
이번 염증성 장 질환 적응증 확대는 크론병 환자 343명과 궤양성 대장염 환자 438명을 대상으로 진행한 글로벌 임상 3상을 바탕으로 이뤄졌다. 앞서 셀트리온이 램시마SC를 미국에서 신약으로 승인받기 위해 진행했던 임상이다. 셀트리온은 오는 29일 짐펜트라(램시마SC 미국명)를 미국 시장에 신약으로 출시할 예정이다.
임상에서 램시마SC는 1차 결과 변수인 임상적 관해와 내시경적 반응률(크론병), 주요 2차 결과변수 모든 항목에서 통계적으로 위약 대비 우월한 유효성과 유사한 안전성을 확인했다.
램시마SC는 기존에는 정맥주사로만 나왔던 인플릭시맙 성분 치료제 중 유일한 피하주사 의약품이다. 환자가 병원을 방문하지 않고 원하는 장소에서 직접 주사할 수 있어 치료 편의성을 크게 개선했고, 임상에서도 기존 정맥주사 제형 대비 강점을 보였다는 설명이다. 셀트리온이 국제학회에서 발표한 램시마SC 글로벌 3상 사후분석 결과에서 램시마SC는 기존 용량(120㎎) 대비 증량 투여(240㎎)에서 효능 회복에 효과를 보인 데 비해 안전성에는 유의미한 차이가 없었다. 또한 램시마SC 단독 투여군에서 면역억제제 병용 투여군 대비 유사한 수준의 유효성과 안전성을 확보했다.
램시마SC는 이 같은 강점을 바탕으로 이미 인플릭시맙 성분의 모든 적응증을 획득한 유럽 시장에서는 유럽 주요 5개국에서 지난해 3분기 기준 20%가량의 시장 점유율을 보이고 있다. 특히 정맥주사 제형의 기존 램시마까지 합치면 시장 점유율은 약 72%에 이른다는 설명이다.
회사 측은 인구수 대비 넓은 영토를 가진 캐나다의 지리적 특성상 자가 투여 방식으로 인한 환자 편의성 증대 효과가 클 것으로 기대하고 있다. 셀트리온 캐나다 법인은 유럽 등에서 누적된 처방 데이터를 바탕으로 제품의 우수성을 전파하고 램시마SC를 염증성 장 질환 분야 선두 치료제로 자리매김한다는 구상이다. 또한 미국·캐나다 양국에서 수익성을 극대화하기 위한 직접판매 체계까지 구축한 만큼 이달 짐펜트라의 미국 내 신약 출시를 통한 시너지도 기대하고 있다.
지금 뜨는 뉴스
셀트리온 관계자는 “캐나다에서 염증성 장 질환 적응증 추가 승인을 통해 램시마SC의 북미 시장 공략에 박차를 가할 수 있게 됐다”며 “글로벌 임상에서 입증한 효능과 안전성을 바탕으로 유럽에서의 성공적인 시장 점유율 확대에 이어 북미에서도 양질의 바이오의약품 공급을 위해 최선을 다하겠다”고 말했다.
이춘희 기자 spring@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>

![전문가 4인이 말하는 '의료 생태계의 대전환'[비대면진료의 미래⑥]](https://cwcontent.asiae.co.kr/asiaresize/319/2026013014211022823_1769750471.png)




















![금·은·비트코인까지 '출렁'…트럼프 선택, 왜 하필 '워시'였나[주末머니]](https://cwcontent.asiae.co.kr/asiaresize/308/2025100509211360399_1759623673.jpg)

![[주末머니]대형마트 새벽배송 허용되면 수혜주는?](https://cwcontent.asiae.co.kr/asiaresize/308/2025120114490338391_1764568143.jpg)