국내 연구팀, 암세포 죽이는 핵심 단백질 발현 성공…부작용 최소화
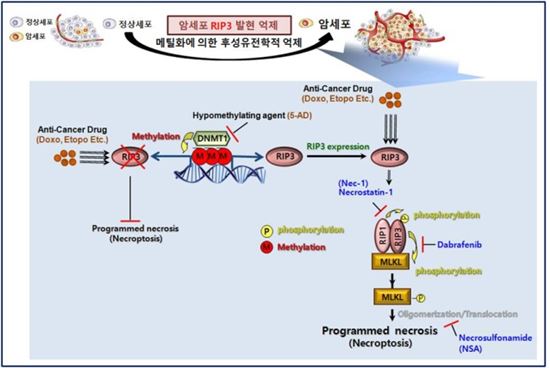
[아시아경제 정종오 기자] 암 치료에 있어 가장 심각한 것은 부작용이다. 항암제는 암세포를 죽이면서 동시에 정상 세포도 함께 죽이기 때문이다. 국내 연구팀이 새로운 세포사멸 프로그램(네크롭토시스)의 한계점을 극복하고 암세포의 항암제 반응성을 극대화함으로써 안전하고 효과적 항암치료의 새로운 가능성을 열었다. 네크롭토시스(Necroptosis)는 RIP1, RIP3, MLKL 단백질에 의해 조절되는 세포사멸 프로그램을 말한다.
이번 연구의 핵심은 암세포에 단백질(RIP3) 발현을 증가시켜 항암제 반응을 촉진시키는데 있었다. 암세포는 죽지 않으려는 특성이 강하다. 이 때문에 치료할 때 환자가 다량의 항암제와 방사선에 노출된다. 건강을 위협 받는다. 적은 양의 항암제에도 암세포가 반응해 죽도록 유도할 수 있다면 항암치료의 위험성을 최소화할 수 있다.
해결의 열쇠는 네크롭토시스를 조절하는 핵심 단백질(RIP3)에 있었다. 그동안 RIP3은 고체형태의 암에서 눈에 띄게 감소돼 새로운 암세포 사멸 전략으로 활용하는 데 한계가 있었다. RIP3은 네크롭토시스 조절의 핵심 단백질로 세린 트레오닌 인산화 효소이다.
연구팀은 암세포에 탈메틸화제를 투여하는 새로운 방식을 도입해 암 발생으로 감소된 RIP3을 복구하는데 성공했다. 동물실험을 통해 고체 형태의 암에 탈메틸화제를 투여해 RIP3 발현을 증가시킨 뒤 항암제를 투입한 결과 항암제만 투여한 그룹에 비해 쥐의 종양이 많이 줄어드는 것을 확인했다. 상대적으로 RIP3의 발현이 높은 환자의 생존율이 높다는 것을 확인했다.
아주대 김유선 교수(교신저자)와 구기방 박사과정(제 1저자)생이 이번 연구를 맡았다. 연구 결과는 네이처 자매지인 셀 리서치(Cell Research) 5월 8일자 온라인판(논문명 : Methylation-Dependent Loss of RIP3 Expression in Cancer Represses Programmed Necrosis in Response to Chemotherapeutics)에 실렸다.
김유선 교수는 "이번 연구는 단백질을 통해 암세포 자살을 유도하는 새로운 사멸 프로그램의 실현 가능성을 한 단계 앞당긴 연구 결과"라며 "RIP3의 조절을 통해 암세포의 항암제 반응성을 높이고 새로운 암세포사멸 프로그램을 기반으로 하는 효율적 암 치료제 개발에 도움이 될 것"이라고 말했다.
정종오 기자 ikokid@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>


![전문가 4인이 말하는 '의료 생태계의 대전환'[비대면진료의 미래⑥]](https://cwcontent.asiae.co.kr/asiaresize/319/2026013014211022823_1769750471.png)



















![[현대차 美 40년 질주]](https://cwcontent.asiae.co.kr/asiaresize/308/2026020612350031914_1770348900.jpg)
![[비트코인 지금]월러 Fed 이사](https://cwcontent.asiae.co.kr/asiaresize/308/2025111806174821076_1763414268.jpg)

![[뉴욕증시]3대 지수 일제히 반등 마감…기술株 저가 매수 심리 유입](https://cwcontent.asiae.co.kr/asiaresize/308/2025011506280389199_1736890083.jpg)