한국글로벌의약산업협회(KRPIA) 연구결과

[아시아경제 이명환 기자] 국내 신약의 허가 및 심사에 걸리는 기간이 평균 314일가량인 것으로 나타났다.
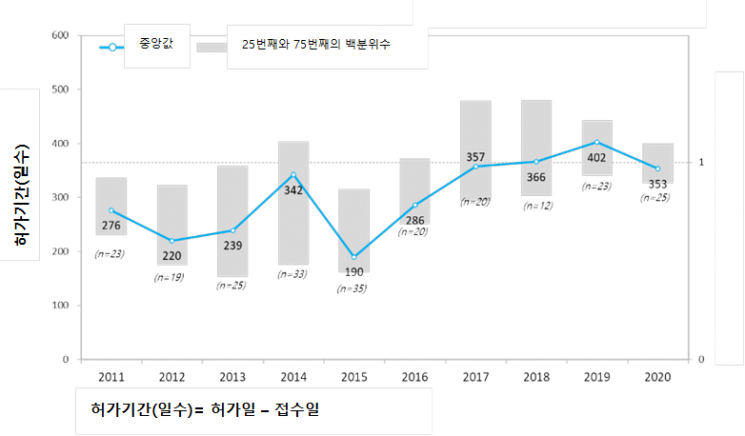
한국글로벌의약산업협회(KRPIA)는 지난 10년간(2011~2020년) 한국에서 허가받은 글로벌제약사의 235개 신약을 대상으로 '한국의 신약 허가 기간에 대한 조사 연구'를 실시했다며 16일 이같이 발표했다.
이번 조사연구 결과에 따르면 조사 기간 허가·심사에 걸리는 기간은 평균 313.7일로 2015년 이후 꾸준히 증가하는 추세를 나타냈다. 2017년까지의 조사 결과인 평균 299.7일와 비교했을 때 2주 정도 늘어난 수치다.
약품별로 살펴보면 합성의약품은 291.0일, 바이오의약품은 353.0일이 걸렸다. 회귀분석 결과 합성의약품 대비 바이오의약품이 평균 43.2일 더 소요되는 것으로 나타났다.
신약 효능군별 비교분석에서는 항암제의 허가 건수가 92건(39.1%)으로 가장 많았다. 효능군 간 기간에 대한 차이는 크지 않았지만 항암제의 허가·심사 기간이 다소 빨랐다.
전체 신약의 37.4%를 차지하는 희귀의약품은 2020년까지 88개의 품목이 허가된 것으로 나타났다. 희귀의약품이 허가까지 걸린 기간은 일반 품목과 비교해 평균 130.4일이 더 빠른 것으로 집계됐다.
다만 2015년 희귀의학품 개발 촉진 및 환자 접근성을 강화를 위해 제정된 '희귀질환관리법'에도 불구하고 2016년 이후 희귀의약품의 허가·심사 기간은 늘어났다. 희귀의약품의 경우 별도의 희귀의약품 지정 절차가 필요해 이를 포함한 총 민원 검토에 드는 기간은 더 늘어나게 됐다. 이는 2015년 7월1일 이후 시행된 희귀의약품에 대한 제조 및 품질관리 기준(GMP) 심사와 위해성 관리 계획의 도입, 바이오 의약품의 증가 등 복합적인 원인이 작용한 것으로 확인됐다는 설명이다.
이번 연구를 통해 허가·심사 과정 중에 GMP 심사 기간이 평균적으로 안전성?유효성 심사나 기준 및 시험방법 심사에 비해 오래 걸리는 것으로 파악됐다고 협회는 설명했다. 특히 GMP 현지 실사 여부 및 일정과 이에 따른 심사 기간은 허가 심사 기간에 큰 영향을 미쳤다.
한편 2020년에는 코로나19 유행 초기 상황에도 불구하고 전년도 대비 허가심사 기간이 오히려 감소한 것으로 나타났다고 설명했다. 이 기간 제조소의 현지 실사 면제가 주원인이라는 추정이 나온다.
지금 뜨는 뉴스
협회는 "2021년 7월20일 약사법이 개정되면서 우선심사·조건부 허가와 같은 신속허가·심사 제도의 개선을 위한 여러 노력이 있었다"면서도 "허가 소요 기간 단축을 위해서는 심사 부서의 전문 인력 확충, 관련 규정의 국제조화 및 외국 규제 기관과의 협력 강화, 상호 인증 제도의 확대 등 지속적인 노력이 필요하다"고 밝혔다.
이명환 기자 lifehwan@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>


![전문가 4인이 말하는 '의료 생태계의 대전환'[비대면진료의 미래⑥]](https://cwcontent.asiae.co.kr/asiaresize/319/2026013014211022823_1769750471.png)






















![일주일 만에 2만원에서 4만원으로 '껑충'…머스크 언급에 기대감 커진 한화솔루션[이주의 관.종]](https://cwcontent.asiae.co.kr/asiaresize/308/2026021109215637724_1770769315.jpg)