[아시아경제 정현진 기자] "미국 워싱턴D.C에서 한때 ‘산업 정책(industrial policy)’이란 단어는 유럽의 사회주의자처럼 보일 수 있어 금기시됐다. 이제 (이 단어는) 백악관, 의회, 싱크탱크, 로비스트 사이에서 반향을 일으키고 있다."(영국 시 주간지 이코노미스트)
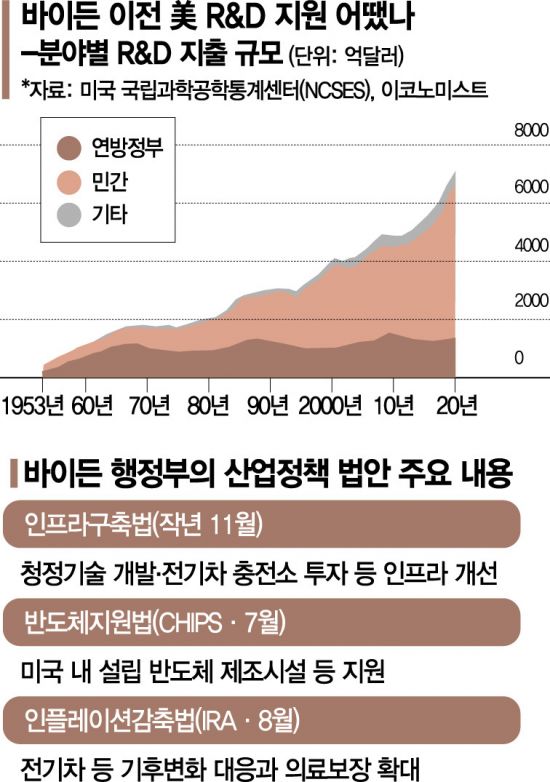
조 바이든 미국 행정부 집권 이후 미국 정부의 산업 정책 기조가 민간기업에서 국가 중심으로 전환하고 있다. 올해 반도체지원법(CHIPS)부터 인플레이션 감축법(Inflation Reduction Act·IRA) 등 연이은 자국 산업 지원 법안으로 ‘메이드 인 아메리카(Made in America)’ 정책이 본격화하고 있는 점이 대표적이다. 국가 주도 산업 정책이 주요국에서 속속 등장하는 상황에서 중국의 경제 성장이라는 위협에 대응한다는 논리를 바탕으로 바이든 행정부는 당분간 이러한 기조를 강하게 밀어붙일 것으로 전망된다.
바이든 행정부는 집권 이후 정부 재정을 활용한 산업 지원책 확보에 속도를 내왔다. 지난해 11월 미국의 열악한 인프라를 개선하겠다면서 1조2000억달러(약 1714조원) 규모의 초대형 인프라법을 마련, 전기차 충전소 구축과 청정에너지 기술 개발 등에 쏟을 예산을 확보했다. 지난 7월에는 반도체 패권을 잡고 미국 내 반도체 제조시설 확보를 위한 반도체 지원법(Chips and Science Act·CSA)이 미 의회 문턱을 넘어섰다. 반도체 제조시설 설립에만 520억달러를 지원해 이를 바탕으로 한국, 대만 등 주요국 투자를 유치하는 바탕이 됐다. 한 달 뒤인 8월에는 바이든 행정부가 인플레 감축법을 마련해 녹색 에너지 전환에만 3700억달러를 투입기로 했다.
이코노미스트는 "이를 모두 합하면 향후 5년간 매해 산업 정책에 투입되는 연간 자금이 1000억달러 수준일 것"이라면서 미 전략국제문제연구소(CSIS)를 인용해 그 규모가 산업 정책으로 묶일 수 있는 기존 지출의 두 배 정도 될 것으로 분석했다. 바이든 행정부는 최근 20억달러를 투입해 미국 바이오산업을 지원하는 ‘국가 생명공학·바이오 제조 이니셔티브’를 마련하기도 했다. 바이든 대통령은 오는 11월 중간선거를 앞두고 연일 이 같은 산업 정책과 입법 성과를 홍보하고 있다. 그는 곳곳에서 "미국 제조업이 돌아왔다. 디트로이트가 돌아오고, 미국이 돌아왔다"면서 바닥을 친 지지율 끌어올리기에 나선 상태다.
바이든 행정부의 이러한 행보에 "정부가 개입하는 유사한 역사는 드물다" "민간 부문보다 정부가 집중하고 있는 것은 이례적"이라는 평가가 나온다. 1980년대 세계주의가 본격화하고 냉전 시대를 거치면서 미국은 자유시장주의를 표방해 정부의 시장 개입을 금기시해왔다. 미 정치매체 폴리티코는 "산업 정책은 로널드 레이건 행정부 이후 수십 년간 크게 인기를 잃었다. 보수주의 강경파에게 이는 소련 경제 느낌을 주는 것이었다"고 전했다.
하지만 상황이 변했다. 미국에서 환영받지 못하던 산업정책이 현시점에 주목받는 이유는 바로 중국과 공급망 재편 때문이다. 중국이 정부의 지원하에 주요 기술 분야에서 급성장하며 미국과 맞붙고, 코로나19로 공급망 위기에 경제가 휘청이는 모습을 확인했다. 미국이 주요 기술 시장에서 주도권을 쥘 필요성이 높아졌다.
미국이 내놓은 지원법안들을 보면 반도체, 전기차, 바이오까지 미국이 패권을 쥐면서 중국을 견제하기 위한 산업 분야가 대부분이다. 바이든 대통령은 이 법안을 ‘국가 안보’를 위한 것이라고 강조했고, 반도체 지원법 등은 ‘야당’인 공화당마저 찬성표를 던졌다.
[이미지출처=로이터연합뉴스]도널드 트럼프 전 행정부에서부터 대중 견제책을 쏟아왔지만 바이든 대통령이 시장 개입 의지가 있는 인물들을 경제 기관에 배치하면서 이러한 정책들이 이어지고 있다는 분석이 나온다. 바이든 행정부 고위 관계자는 폴리티코에 "우리 노력의 일부는 산업 개발에 정부가 적절한 역할을 갖고 있다는 생각을 할 수 있도록 여지를 만드는 것"이라고 말했다.
다만 일각에서는 이러한 국가 주도형 산업 정책이 미국의 제조업 강화라는 성공을 거둘 수 있을지 미지수라는 비판의 목소리가 나온다. 미국 기업의 성장에 초점을 맞춰 효율적으로 자금을 집행할 수 있는가 하는 의문도 있다. 실제 버락 오바마 행정부 당시 태양광 패널 업체 솔린드라에 정부가 5억3500만달러 대출 보증을 해줬는데 2년 만에 파산한 적도 있다. 당시 오바마 전 대통령은 이 업체를 ‘미국의 미래’라고까지 했지만 중국의 저가 패널 공세에 밀려 파산하고 말았다.
당장 미국에서 국가 주도의 산업 정책을 펼친 분야는 국방 산업 정도인데, 국방 외에는 지원법에 따른 자금 집행을 비롯한 관리할 시설조차 없다는 지적이 있다. 바이든 행정부는 반도체 지원법과 인플레 감축법 통과 이후 이를 총괄하기 위한 대응팀을 별도로 만들고 이전 행정 경험이 있는 인물들을 팀에 배치, 효율적인 지원을 위한 논의를 하겠다고 밝힌 상태다.
빌 클린턴 전 행정부 이후 여러 차례 정부에서 일하며 산업 정책을 지지해온 로버트 앳킨슨 정보기술혁신재단(ITIF) 회장은 "산업 정책이 작동하지 않는 건 아니다"면서도 "적절한 시기에 해야 한다. 상당한 능력을 한번 잃고 경쟁자가 이를 확보하면 할 수 있는 건 얼마 없다"고 지적했다. 루스벨트연구소의 토드 터커 산업 정책 전문가는 "상무부 관계자들은 미국 소유 기업들이 자금을 받길 원한다고 한다. 하지만 이미 배는 부두를 떠났고 이제 많은 외국 기업들이 선두에 서 있다"고 말했다.
정현진 기자 jhj48@asiae.co.kr
<ⓒ경제를 보는 눈, 세계를 보는 창 아시아경제(www.asiae.co.kr) 무단전재 배포금지>