해외 개발 백신만으론 국내 수급 안정화 어려워
'인기 높은' mRNA 백신 임상 중 기업 1곳뿐
[아시아경제 김지희 기자, 이춘희 기자] 셀트리온이 직접 코로나19 백신을 만들겠다고 선언한 배경엔 우리나라의 ‘토종’ 백신 개발에 속도를 내겠다는 의지가 담겨 있다. 세계적으로 변이 바이러스가 확산하는 팬데믹(세계적 대유행) 속에서 해외 개발 코로나19 백신만으로 국내 백신 수급의 안정화를 도모하기는 어려워진 상황이다.
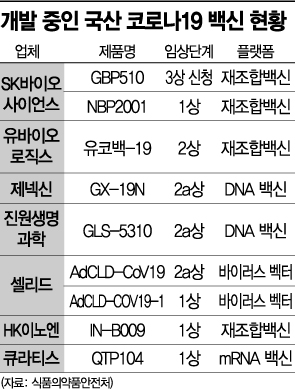
4일 식품의약품안전처에 따르면 국내에서 임상시험 계획을 승인받아 현재 임상을 진행 중인 국내 백신은 총 10개다. 재조합 백신 5종, DNA 백신 3종, 바이러스 벡터 백신 1종, mRNA 백신 1종이다. 현재로서는 대부분 임상 1, 2상 단계에 머물러 빨라야 내년 상반기께나 본격적인 출시를 기대할 수 있는 실정이다.
가장 개발 속도가 빠른 곳으로는 SK바이오사이언스가 꼽힌다. 현재 ‘GBP510’과 ‘NBP2001’ 등 2개 후보물질을 개발 중인 SK바이오사이언스는 지난 6월 GBP510에 대해 임상 3상 시험계획서를 식약처에 제출하고 승인을 기다리고 있다. 임상 승인이 이뤄지면 유럽, 동남아 등에서 순차적으로 임상 3상을 신청할 계획이다. 내년 상반기 상용화가 목표다.
DNA 백신 플랫폼 기반으로 ‘GX-19N’을 개발 중인 제넥신도 기대를 모은다. 국내에서 가장 먼저 2상에 진입한 제넥신은 지난달 인도네시아 식품의약품감독청(BPOM)으로부터 임상2·3상 계획을 승인받았다. 업계 관계자는 "국산 백신 상용화가 내년에나 가능할 것으로 예상되면서 시장 규모에 대한 우려가 있었으나 최근 분위기가 조금씩 희망적으로 바뀌고 있는 것은 사실"이라며 "후발주자인 국내 업체들은 대부분 변이 바이러스 대응을 목표로 개발을 이어가고 있다"고 설명했다.
다만 최근 세계적으로 인기가 높은 mRNA 백신의 임상을 진행 중인 곳은 국내에선 큐라티스가 유일하다. mRNA 백신 개발을 위해 대형 제약 3사가 뭉치기도 했다. 한미약품·GC녹십자·에스티팜은 최근 한국혁신의약품컨소시엄(KIMCo)의 지원 아래 ‘차세대 mRNA 백신 플랫폼 기술 컨소시엄’을 출범시겼다. 내년까지 전 국민 1회 접종이 가능한 1억회분의 mRNA 기반 코로나19 백신을 생산하고, 2023년 10억회분을 생산해 수출까지 추진한다는 청사진이다.
셀트리온은 그동안 백신 개발에 뛰어들 가능성에 대비해 준비작업을 진행해온 것으로 전해졌다. 서정진 셀트리온 명예회장은 지난 2월 "백신 기술 자립이 이뤄지지 않을 경우 백신까지 진출할 준비는 하고 있다"면서도 "다른 대안이 없다면 어쩔 수 없이 하겠다는 의미"라며 신중한 입장을 보였다. 이와 관련 셀트리온 관계자는 "이번 협업으로 자체 mRNA 플랫폼 기술을 확보하고 다양한 분야의 신약 개발에 적용해 신약 포트폴리오 확장에도 나서겠다"고 전했다.
정부는 국산 백신 확보는 우리 정부의 협상력 측면에서도 중요하다고 보고 있다. 손영래 중앙사고수습본부 사회전략반장은 "어떤 형태로든 국내 백신을 갖고 있는 것이 매우 중요하다"며 "안정적인 공급과 가격, 협상력 등을 고려할 때 궁극적으로 국산 mRNA 백신까지 필요하다"고 말했다.
김지희 기자 ways@asiae.co.kr
이춘희 기자 spring@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>




![[포토]BTS 데뷔 10주년 맞아 하이브 앞 찾은 외국인관광객들](https://cwcontent.asiae.co.kr/asiaresize/276/2023061308571161328_1686614230.jpg)

![[포토] '발리댁' 가희, 탄탄한 복근](https://cwcontent.asiae.co.kr/asiaresize/276/2022101417545469305_1665737695.jpg)